Búsqueda Simple
Búsqueda Completa
Taxonómica
Anatomía
+ Teoría
Patología
Aleatorio Principio Activo/ComercialFármacos o Drogas Más Visitadas
Levomepromazina

707355 visitas
Desvenlafaxina

273480 visitas
Clobenzorex
271940 visitas
Quetiapina

239062 visitas
Acepromazina
208539 visitas
Últimos comentarios
![]()
CLASIFICACIÓN VARIOS 2
Nombre: Biperideno
Comercial: Akineton
Foto: 
Fórmula: 
Fármaco consultado: 30153 veces
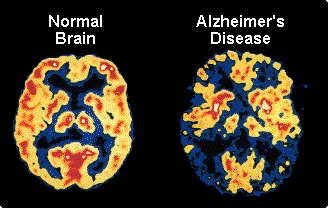
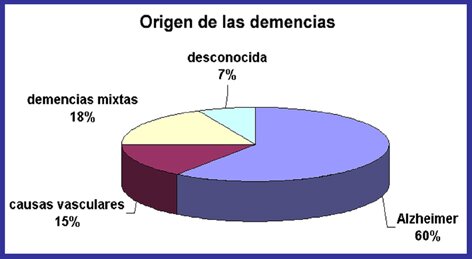
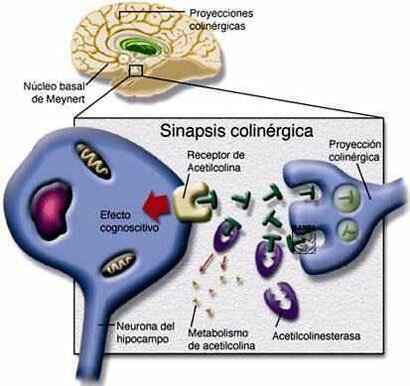
Enfermedad de Alzheimer - exploraciones PET muestran en los pacientes con Alzheimer leve y más en casos avanzados el metabolismo de glucosa se reduce tanto en los lóbulos temporal y parietal. Los pacientes con una mayor cantidad de disfunción del lenguaje, que problemas con la vista espacial muestran una reducción significativa en el metabolismo en el frontal izquierdo, lóbulos temporal y parietal. Los casos con mayor deterioro espaciales visuales tienen un metabolismo de la glucosa disminuida en el lóbulo parietal derecho.
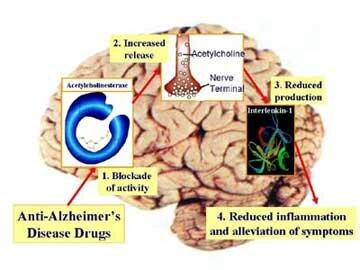

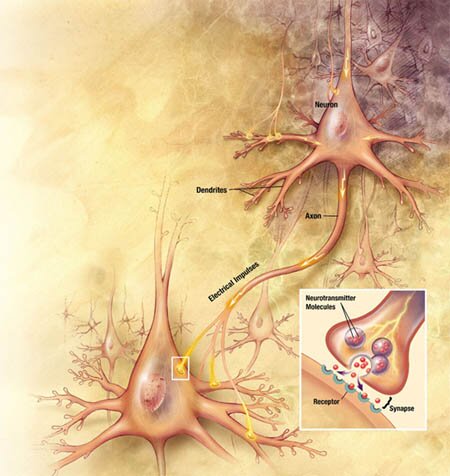
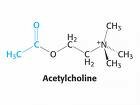
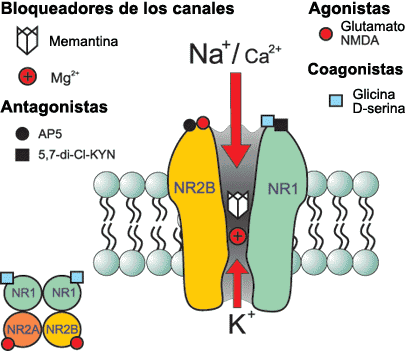
Inactivación de la Acetilcolina
El sistema de transporte vesicular de la Acetilcolina, responsable de la concentración de Acetilcolina en las vesículas sinápticas, ha sido caracterizado recientemente, a nivel molecular y funcional, e involucra un sistema torpedo electromotor especializado; la comparación del transporte de la Acetilcolina con los de las monoaminas demuestra la existencia de una nueva familia de genes; el mapeo de genes ha mostrado una única relación entre los genes para el transporte vesicular de la Acetilcolina y para la Colina-acetil-transferasa.
Una vez liberada a al hendidura sináptica, la acetilcolina se une durante un tiempo muy corto a sus receptores postsinápticos antes de ser degradada por la acetilcolinesterasa (AchE) que esta concentrada en la hendidura.
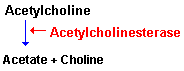 La AchE es una glucoproteína globular que esta presente en los nervios, músculos y eritrocitos de los vertebrados y es especifica para la misma aceticolina. Esta enzima se sintetiza en el cuerpo celular y se distribuye a través de al neurona mediante flujo axoplasmico.
La AchE es una glucoproteína globular que esta presente en los nervios, músculos y eritrocitos de los vertebrados y es especifica para la misma aceticolina. Esta enzima se sintetiza en el cuerpo celular y se distribuye a través de al neurona mediante flujo axoplasmico.
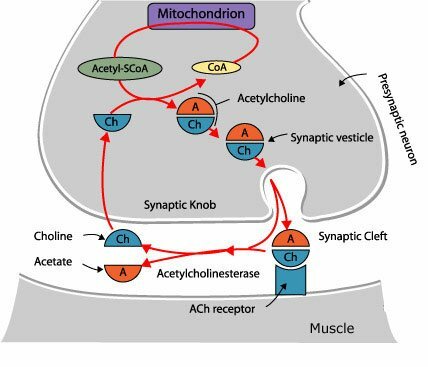
 La degradación hidrolítica de la Acetilcolina se lleva a cabo a nivel extracelular, en la proximidad de la terminación nerviosa, gracias a la acción de la Acetilcolinesterasa, que desdobla la Acetilcolina a sus componentes originales. Las aminas biogénicas en su mayoría son desactivadas por recaptación en las terminaciones nerviosas por las cuales fueron descargadas. Se ha demostrado la existencia de sistemas de captación altamente efectivos y específicos en todos los neurotransmisores del sistema nervioso central (Noradrenalina, Dopamina, Serotonina, GABA, Glutamato, Aspartato, Glicina), pero no para la Acetilcolina. Sin embargo, pese a que la Acetilcolina no tiene transportador, si existe un transportador de alta afinidad para su precursor, la Colina. Al parecer es probable que la desactivación por recaptura sea el mecanismo universal para la desactivación de las aminas y aminoácidos neurotransmisores; y que la degradación enzimática en el caso de la Acetilcolina es una excepción a la regla.
La degradación hidrolítica de la Acetilcolina se lleva a cabo a nivel extracelular, en la proximidad de la terminación nerviosa, gracias a la acción de la Acetilcolinesterasa, que desdobla la Acetilcolina a sus componentes originales. Las aminas biogénicas en su mayoría son desactivadas por recaptación en las terminaciones nerviosas por las cuales fueron descargadas. Se ha demostrado la existencia de sistemas de captación altamente efectivos y específicos en todos los neurotransmisores del sistema nervioso central (Noradrenalina, Dopamina, Serotonina, GABA, Glutamato, Aspartato, Glicina), pero no para la Acetilcolina. Sin embargo, pese a que la Acetilcolina no tiene transportador, si existe un transportador de alta afinidad para su precursor, la Colina. Al parecer es probable que la desactivación por recaptura sea el mecanismo universal para la desactivación de las aminas y aminoácidos neurotransmisores; y que la degradación enzimática en el caso de la Acetilcolina es una excepción a la regla.
La Acetilcolinesterasa se localiza primordialmente en neuronas colinérgicas (dendritas, pericariones y axones), en la proximidad de las sinapsis colinérgicas, y otros tejidos. De modo predominante, se localiza en las uniones neuromusculares, ganglios vegetativos, terminaciones nerviosas parasimpáticas y núcleo caudado. El plasma sanguíneo contiene un tipo inespecífico de la misma enzima conocido como Pseudocolinesterasa (Colinesterasa, Esterasa sérica o Butiril Colinesterasa)
Fuentes:
Hipótesis de trabajo en la búsqueda de nuevos fármacos
Las lesiones características de la enfermedad de Alzheimer se encuentran descritas desde principios del siglo XX y son las denominadas placas seniles, formadas por un péptido amiloide en un estado anómalo de agregación, y los ovillos neurofibrilares, que se localizan dentro de las neuronas formados por una proteina denominada tau en un estado aberrante de hiperfosforilación. Estas dos lesiones histopatológicas junto con la pérdida de las neuronas fundamentalmente colinérgicas, constituyen las bases moleculares de la enfermedad de Alzheimer. A partir de ellas, y con el fín de encontrar fármacos eficaces que acaben con esta enfermedad devastadora, se han originado tres hipótesis de trabajo:
ANTIDEMENCIALES:
HIPÓTESIS COLINÉRGICA:
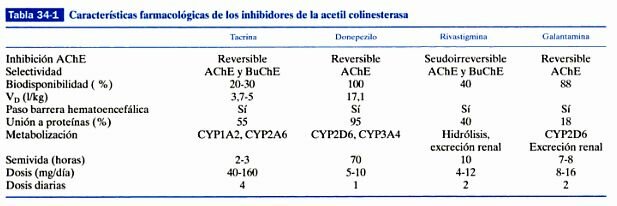
En la que se intenta restaurar los niveles del neurotransmisor (acetilcolina) involucrado en los procesos de aprendizaje y memoria. Siguiendo estas ideas se inició una investigación farmacéutica intensa en la década de los 80 que concluyo con la aparición en el mercado de los actuales fármacos en uso como son tacrina, donepezilo, rivastigmina y galantamina. Son fármacos paliativos, pues mejoran la sintomatología del paciente sin llegar a interferir en el proceso neurodegenerativo.
En la enfermedad de Alzheimer, desde su inicio y a lo largo de la misma, falta en el cerebro una sustancia llamada acetilcolina, imprescindible para que el sistema de neuronas que la utiliza funcione normalmente trasmitiendo, a través de las sinapsis, los impulsos nerviosos por todo el circuito. Sin acetilcolina cerebral no hay memoria ni razonamiento. Por tanto, los enfermos van a mejorar si reciben agentes que les proporcionan esta sustancia. El donepezilo, la rivastigmina y la galantamina actúan en el cerebro mejorando la función de la acetilcolina. Todas las sustancias neurotrasmisoras que hay y se necesitan en el cerebro para un normal funcionamiento (como la dopamina, noradrenalina, serotonina, la susodicha acetilcolina, etc.) se han de sintetizar momento a momento, consumirse al realizar su misión de trasmitir impulsos acoplándose a las moléculas receptoras o receptores y, naturalmente, degradarse. Este un ciclo permanente y repetido diariamente. Esta degradación o metabolismo en el caso concreto de la acetilcolina la realiza una proteína o enzima llamada acetilcolinesterasa. La única manera que los científicos descubrieron hasta ahora de aumentar la acetilcolina en el cerebro de los enfermos con Alzheimer fue anular o inihibir la acción de este enzima. Por eso, los medicamentos que logran tal efecto se llaman anticolinesterásicos. Entre los tres medicamentos anticolinesterásicos disponibles hay diferencias en cuanto a su composición química, potencia, selectividad y modo de inhibir la acetilcolinesterasa, dosis, tiempo que permanecen en la sangre una vez absorbidos en el tubo digestivo, manera de viajar en la sangre para llegar al cerebro y mecanismo de eliminación del organismo. La rivastigmina tiene la peculiaridad de inhibir también otro enzima, llamado burtirilcolinesterasa, lo que puede conferirle un singular efecto clínico. Y la galantamina, además de inhibir, aunque sea débilmente la acetilcolinesterasa, destaca porque potencia la acción de los receptores neuronales a los que se acopla la acetilcolina, propiedad que la dota de un papel de protección neuronal.
Fuente: Farmacología Humana Jesús Flórez.
HIPÓTESIS AMILOIDE:
Hipótesis amiloidea de la enfermedad de Alzheimer
Los marcadores histopatológicos principales de la enfermedad de Alzheimer corresponden a las placas de amiloide y a los haces neurofibrilares. El principal componente de las placas es el péptido A-beta, cuya secuencia forma parte de una proteína precursora integral de membrana: la proteína precursora de amiloide (PPA). Esta es seccionada de manera secuencial por diferentes secretasas, lo cual resulta en la producción del péptido A-beta.
La proteína tau, esencial para la estabilización de los microtúbulos neuronales, se hiperfosforila en la enfermedad de Alzheimer, lo que ocasiona un cambio en su conformación que favorece la producción de haces filamentosos. La acumulación de estos últimos coincide con las etapas previas a la muerte del paciente, por lo cual se discute si el objetivo del tratamiento debe ser el A-beta o la proteína tau. Sin embargo, estudios recientes refieren que la acumulación regional de A-beta y de placas también se asocia con la progresión de la enfermedad.
La mayoría de los casos de enfermedad de Alzheimer de carácter esporádico; el factor de riesgo principal es la edad, con inicio característico de la enfermedad entre los 80 y 90 años. No obstante, existen casos raros de causa genética única, los cuales corresponden al tipo familiar autosómico dominante. En este caso los síntomas se presentan a edad temprana, aunque la enfermedad es clínica e histopatológicamente idéntica a los casos esporádicos.
El estudio genético de la enfermedad de Alzheimer familiar ofrece la evidencia más clara sobre la hipótesis amiloidea. La mutación específica que ocasiona la enfermedad familiar puede ubicarse en tres genes: el gen de la PPA, en el cromosoma 21, y en dos genes denominados "presenilin" 1 y 2, ubicados en los cromosomas 14 y 1 respectivamente. Estas mutaciones resultan en una secreción aumentada de A-beta. Por lo tanto, la fisiopatología de la enfermedad familiar comienza con la secreción de A-beta, lo cual sugiere que el paso inicial en la enfermedad esporádica sería el clivaje de la PPA. Aún deben estudiarse los factores adicionales que contribuyen a la acumulación del A-beta, pero el péptido es, actualmente, el objeto de muchas investigaciones sobre alternativas terapéuticas. Numerosos investigadores, sin embargo, sugieren que la fosforilación de la proteína tau es un blanco terapéutico más promisorio. Es incierto el papel fisiológico del A-beta; se cuenta con algunas evidencias sobre su actividad neurotrópica. No obstante, se sabe que participa en la cascada neurodegenerativa asociada con la enfermedad de Alzheimer.
Las investigaciones en este área se iniciaron una década mas tarde y actualmente hay diversos fármacos en diferentes estadios de desarrollo clínico. Se espera que a partir del 2011 se inicie la comercialización de alguno de ellos como fármacos modificadores del proceso neurodegenerativo. También, es importante señalar en este punto los diferentes estudios llevados a cabo con las técnicas de inmunización, activa y pasiva, o lo que es denominado como vacuna del Alzheimer. Aunque los primeros ensayos en pacientes tuvieron que ser suspendidos por la aparición de acontecimientos adversos graves, actualmente se han avanzado otras estrategias que los próximos años confirmaran o no las esperanzas depositadas en ellas.
Modulación de las secretasas:
Actualmente ningún fármaco ha pasado de la Fase III de investigación, han sido suspendidos todos (Tarenflurbil,Semagacestat,Avagacestat).
Las mutaciones de las presenilinas son la causa más común de enfermedad de Alzheimer familiar, y afectan el complejo de la gamma secretasa. Sin embargo, esta enzima tiene sustratos variados, y su inhibición ocasiona alteraciones a nivel gastrointestinal, entre otras. Según lo refiere la información reciente, es posible modular la acción de la enzima de manera que disminuya la producción de A-beta42, la forma más tóxica del péptido, sin afectar su actividad fisiológica. Esta acción moduladora es compartida por numerosos antiinflamatorios no esteroides (AINE) administrados a altas concentraciones. Actualmente un inhibidor de la gamma secretasa ha alcanzado la fase I de investigación, el LY450139, que reduce la concentración plasmática de A-beta en adultos sanos.
La beta secretasa, en cambio, es un blanco más promisorio y su sitio activo ha sido estudiado en profundidad. La enzima pertenece a la familia de las proteasas del ácido aspártico, al igual que la proteasa del HIV para la cual se elaboró un inhibidor específico. Por lo tanto, la obtención de un inhibidor específico para la secretasa beta parece posible; su administración sería tolerable y aminoraría el curso de la enfermedad. No obstante, aún no se llegó a la fase clínica de investigación de estas drogas.
La alfa secretasa previene la liberación de A-beta. Los activadores de la proteína quinasa C son también activadores de esta secretasa, pero promueven la formación de tumores; de modo que el objetivo principal es obtener un activador de la proteína quinasa C que aumente la actividad de la alfa secretasa sin favorecer el desarrollo tumoral.
Inhibidores de la proteína activadora de la Gamma-Secretasa GSAP (Gamma-Secretase Activating Protein):
Una versión alterada del medicamento Gleevec contra el cáncer conforma la base de una nueva clase de fármacos que bloquea el desarrollo de placas cerebrales dañinas que son características en la enfermedad de Alzheimer, indicó un grupo de investigadores estadounidenses.Los expertos esperan que los laboratorios puedan hacer pequeños ajustes a la fórmula de Gleevec -una píldora que ha transformado el tratamiento de un tipo de leucemia- para que funcione de manera segura en el cerebro. La clave está en la enzima que impulsa la producción de placas beta amiloide, uno de los patrones clásicos de la enfermedad de Alzheimer. Gleevec, usado para tratar la leucemia mieloide crónica, bloquea esta proteína activadora de gamma secretasa.
\”Nuestros hallazgos revelan que la proteína activadora de gamma secretasa es un posible blanco para una nueva clase de terapias contra la (placa beta) amiloide\”, indicó Paul Greengard, ganador del Premio Nobel en el 2000 por su investigación sobre cómo se comunican las neuronas. Greengard trabajó en este estudio, publicado en la revista Nature. En un trabajo previo, el experto descubrió que el fármaco Gleevec de Novartis AG, genéricamente denominado imatinib, bloquea la proteína activadora de gamma secretasa.
El último estudio dirigido por Gen He, investigador del laboratorio de Greengard, muestra que esta proteína aumenta de forma drástica la producción de beta amiloide, y que al bloquearla en ratones genéticamente modificados se evitaba la formación de placas cerebrales que intervienen en el desarrollo de la condición.
Greengard advirtió que Gleevec se elimina muy rápidamente del cerebro como para prevenir la enfermedad de Alzheimer “por su cuenta”, pero el experto cree que las empresas farmacéuticas podrían hallar formas de que el fármaco permanezca activo en el cerebro por más tiempo.
\”El desarrollo de compuestos que funcionan como Gleevec, pero que tengan la capacidad de pasar la barrera sanguínea cerebral y apuntar a la proteína activadora de gamma secretasa podría revolucionar el tratamiento de esta enfermedad\”, indicó Greengard en un comunicado.
El científico destacó que Gleevec podría modificarse químicamente para que no sea eliminado de manera rápida. “Estoy seguro de que al publicarse nuestro estudio, una serie de compañías farmacéuticas tratarán de hacer exactamente eso\”, añadió.
La proteína activadora de gamma secretasa es más específica que otros medicamentos que se usan contra la afección, ya que apuntan a la gamma secretasa directamente. Eso se debe a que la proteína no interfiere con el Notch, un sendero de señalización celular vital, que juega un papel central en el desarrollo del sistema inmune, precisó el experto.
\”Se sabe que la gamma secretasa no solo fabrica beta amiloide, sino que también genera muchas otra sustancias que son vitales para la supervivencia de nuestras células\”, explicó Greengard sobre el fracaso de los fármacos que apuntan directamente a ella.
La enfermedad de Alzheimer es una condición letal que afecta a 26 millones de personas en el mundo, ofrece un mercado tentador para las compañías farmacológicas, pero hasta el momento ha demostrado ser un blanco complejo. En la actualidad, los fármacos disponibles tratan los síntomas, pero no pueden atacar de forma definitiva el deterioro mental que elimina en las personas que sufren la enfermedad la capacidad de pensar y cuidarse por sí mismos.
Chicago, septiembre 2/2010 (Reuters)
Inmunoterapia;
Actualmente ningún fármaco ha pasado de la Fase III de investigación, han sido suspendidos todos (Solanezumab,Bapineuzumab).
Las investigaciones para la obtención de una vacuna se iniciaron en modelos animales, con resultados positivos. Según estudios previos, la inmunización con agregados mixtos de A-beta puede resultar en la producción de anticuerpos contra el extremo amino terminal del péptido. Además, estos últimos favorecerían la fagocitosis de las placas de amiloide por parte de las células microgliales; pero la investigación en pacientes con enfermedad de Alzheimer se detuvo durante la fase II, dado que el 6% de los individuos presentó meningoencefalitis a causa de la vacunación. A pesar de esta situación, varios informes insisten en señalar posibles beneficios del tratamiento, lo que ha provocado la continuación de las investigaciones alternativas sobre inmunoterapia; por ejemplo, se propone la aplicación de la inmunización pasiva mediante anticuerpos monoclonales antiamiloide, estrategia que parece originar riesgos mínimos, aunque se requeriría la infusión intravenosa periódica, con lo cual existe la posibilidad de aparición de anticuerpos neutralizantes y complejos inmunes.
Estrategias no inmunológicas de unión al amiloide:
La principal teoría sobre la eficacia de la inmunoterapia es la generación de anticuerpos que se unen al A-beta de las placas, lo cual permitiría la fagocitosis. Pero al parecer hay mecanismos de acción alternativos; por ejemplo, la unión a las placas de amiloide sin inducción de la fagocitosis resultaría en la disrupción de éstas. También existe evidencia sobre el secuestro de A-beta en la periferia de las placas mediante agentes de unión, con reducción de la carga cerebral del péptido.
En la actualidad hay un creciente interés por la implementación de terapias no inmunológicas. Los agentes se unirían al A-beta o alterarían su conformación, lo que puede resultar en el secuestro periférico de éste y en su alteración en la disposición natural en el cerebro.
Es importante determinar la toxicidad de las diferentes conformaciones que puede tomar el A-beta; por ejemplo, si el depósito de la forma fibrilar es lo que causa el daño, es útil la prevención de la polimerización. En cambio, si los depósitos son inertes y el origen del deterioro son las formas difusibles, la solubilización de las fibras podría resultar peligrosa. Si bien aún no se han obtenido conclusiones definitivas al respecto, se cree que la intervención más útil sería la que altere la conformación del A-beta y reduzca las formas fibrilar y soluble del péptido en el cerebro.
Estrategias de inhibición de la polimerización:
Actualmente ningún fármaco ha pasado de la Fase III de investigación, han sido suspendidos todos (Tramiprosato).
Se evaluó la interacción de dos agentes con el A-beta para reducir su polimerización y promover su depuración cerebral. El clioquinol es una droga quelante de metales que se utilizó en el pasado para el tratamiento de las parasitosis intestinales. Según estudios in vitro, disminuye la polimerización del A-beta y, según se observó en modelos animales, reduce la carga cerebral del péptido. Los resultados obtenidos en pacientes con enfermedad leve a moderada señalan que el tratamiento parece resultar en una rápida mejoría cognitiva. Esto sugiere que las dificultades cognitivas estarían mediadas directamente por el A-beta. La droga fue retirada del mercado años atrás debido a su toxicidad en el nervio óptico; pero se estudian drogas quelantes alternativas.
La segunda droga investigada es el tramiprosato. Su mecanismo de acción consistiría en la interacción con la región de unión a los glicosaminoglicanos de la forma soluble del A-beta, con el fin de disminuir su polimerización. La droga se encuentra en fase III de investigación, y los resultados son promisorios. Se informó que produce beneficios a nivel cognitivo, particularmente en los pacientes con enfermedad leve.
Otros agentes actualmente investigados son los péptidos análogos al A-beta, compuestos relacionados con la tinción histológica del A-beta como el Rojo Congo, y otras moléculas. Varias de las estrategias no tienen mecanismos de acción establecidos; por ejemplo, la reducción del colesterol mediante estatinas, que al parecer produce una mejoría cognitiva, es actualmente evaluada en numerosos trabajos.
HIPÓTESIS TAU:
Es la mas reciente de todas ellas, y sin embargo, al dia de hoy una de las mas prometedoras, pues se ha comprobado que el grado de demencia es directamente proporcional al número de ovillos neurofibrilares encontrados en los pacientes de Alzheimer y tambien de otras demencias denominadas tauopatias. Actualmente, un fármaco cuyo mecanismo molecular está basado en esta hipótesis se encuentra en desarrollo clínico con el fin de poder mostrar su eficacia en pacientes.
Dosis

Fuentes:
La demencia con cuerpos de Lewy (DCL) es la tercera causa de demencia detrás de la enfermedad de Alzheimer y la demencia vascular. Se considera una prevalencia de alrededor del 10 al 20 por ciento del total de casos de demencia.
Es una enfermedad neurodegenerativa. Su etiología no está aclarada. Su diagnóstico de certeza sólo puede hacerse post mortem, con la demostración de la presencia en la corteza frontal, parietal y temporal, y en la sustancia negra, de los cuerpos de Lewy, que designan a unas estructuras incluidas en las neuronas y que corresponden a degeneración de su citoplasma formadas por la acumulación anormal de proteínas, fundamentalmente de alfa-sinucleína, la cual se identifica con certeza mediante técnicas inmunohistoquímicas.
Los síntomas de la enfermedad incluyen la presencia de deterioro cognitivo, similar a lo que podemos observar en la demencia tipo Alzheimer, además de la aparición de síntomas de parkinsonismo (lentitud de movimientos, rigidez articular y a veces temblor), alucinaciones, delirios o respuestas anormales a diversos fármacos. Las fluctuaciones son otro de los síntomas cardinales de la enfermedad.
Hasta la aparición en 1996 de los criterios diagnósticos del Taller Internacional del Consorcio para la Demencia con Cuerpos de Lewy, los casos de esta enfermedad solían ser erróneamente clasificados como enfermedad de Alzheimer (EA), enfermedad de Parkinson (EP) o la superposición de ambas.
Aún hoy la demencia con cuerpos de Lewy es infradiagnosticada clínicamente. Constituye más del 10% de todos los casos de demencia que llegan a la necropsia, pero los estudios de muestras clínicas informan que sólo alrededor de un 5% tienen el síndrome de DCL.
La demencia con cuerpos de Lewy (DCL) es una entidad clínico-patológica descrita recientemente. Sus principales características clínicas son el deterioro mental, parkinsonismo de intensidad variable, rasgos psicóticos como las alucinaciones visuales (AV), y fluctuaciones del estado cognitivo que afectan especialmente a la atención y concentración. Hasta la aparición en 1996 de los criterios diagnósticos del Taller Internacional del Consorcio para la Demencia con Cuerpos de Lewy, los casos de DCL solían ser erróneamente clasificados como enfermedad de Alzheimer (EA), enfermedad de Parkinson (EP) o la superposición de ambas. Aún hoy la DCL es infradiagnosticada clínicamente. Constituye más del 10% de todos los casos de demencia que llegan a la necropsia, pero los estudios de muestras clínicas informan que sólo alrededor de un 5% tienen el síndrome de DCL.
Inicialmente esta demencia suele ser diagnosticada como EA o DV pero, posteriormente y ante la presencia de síntomas parkinsonianos, el clínico la clasifica como DCL. En otros casos, los pacientes presentan inicialmente síntomas clásicos de la EP y más tarde desarrollan la demencia; solo una minoría de pacientes presenta inicialmente los síntomas de ambos trastornos.
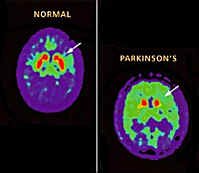
Enfermedad de Parkinson - Los pacientes tienen un mayor flujo al normal de sangre en los ganglios basales en el lado opuesto a las extremidades. L-dopa reduce el flujo de sangre a los ganglios de la base pero con el tiempo puede aumentar la tasa metabólica local. También hay una falta de comunicación entre el frontal y parietal y frontal con los lóbulos occipitales. Metabolismo de la glucosa también disminuyó en general en el cerebro sobre un 18% en comparación con una persona normal de la misma edad.
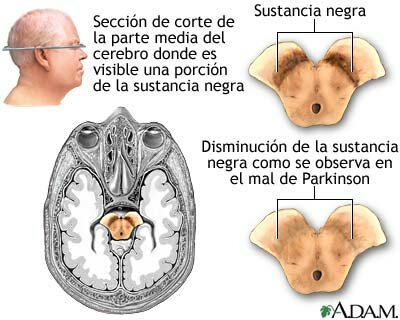
La enfermedad de Parkinson se caracteriza por la pérdida o degeneración de las neuronas dopaminérgicas en la sustancia negra y la formación de cuerpos de Lewy en dichas neuronas.
La alteración de la y su acumulación en los cuerpos de Lewy tiene una mayor extensión y afecta otras zonas y sistemas neuronales, como el colinérgico, el noradrenérgico y el serotoninérgico.
***Es una enfermedad neurológica degenerativa que evoluciona a lo largo de los años y que suele aparecer en sujetos de edad avanzada. En la enfermedad de Parkinson la destrucción progresiva de una región específica del cerebro (la sustancia negra) desemboca en la aparición de síntomas cada vez más graves que pueden llegar a producir la muerte del paciente.
En el cerebro existe un grupo de células nerviosas encargadas de producir dopamina, un neurotransmisor esencial para el control de los movimientos y la transmisión del impulso nervioso. Estas neuronas se agrupan en una estructura denominada sustancia negra -por tener un color oscuro en los cadáveres-, que se sitúa en los ganglios basales.
Las neuronas de la sustancia negra de los sujetos con enfermedad de Parkinson mueren antes de tiempo sin ser sustituidas por otras nuevas. Cuando desaparece el 50 ó 60% de estas células de esta zona comienzan a hacerse evidentes los primeros síntomas: temblores, rigidez o dificultad para la marcha o el mantenimiento de la postura
LA ENFERMEDAD DE PARKINSON (EP) es un desorden neurodegenerativo de los ganglios basales (véase el capítulo II) que progresa hasta dejar al paciente incapacitado para efectuar movimientos voluntarios. Se observa aproximadamente en el 1% de la población mayor de 55 años, edad en la que la enfermedad es más frecuentemente diagnosticada. La EP se detecta primero como un ligero temblor en una o varias extremidades, rigidez muscular, anomalías posturales y lentitud de movimientos. Estos síntomas se pueden acompañar de pérdida del apetito y la subsecuente pérdida de peso, depresión, disminución de la capacidad intelectual y disfunciones autónomas (p. ejem., estreñimiento, seborrea, disfunción de la vejiga, hipotensión, sudoración excesiva, disfagia (dolor al deglutir), intolerancia al calor, alteraciones vasomotoras e impotencia sexual). La severidad de los síntomas puede aumentar en el transcurso de 10 a 15 años hasta reducir al paciente a un estado de completa inmovilidad y de demencia
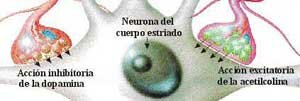
Durante aproximadamente 25 años el centro de la atención, en torno al tratamiento de la Enfermedad de Parkinson, estaba en el estriato (en realidad se refiere al neo estriato, es decir putamen y caudado pues es filogenéticamente más reciente que el paleo estriato o globus pallidus). En efecto se sabía que los neurolépticos bloqueaban los receptores dopaminérgicos post sinápticos a nivel del estriato causando un síndrome parkinsoniano que por esto no podía ser revertido administrando Levodopa. En el estriato había receptores D2 que inhibían la descarga post sináptica (al bloquear la enzima adenylciclasa) sobre los cuales se ejercía el efecto beneficioso de la Levodopa. Es decir la Levodopa es fundamentalmente un neurotransmisor depresor o bloqueador post sináptico. Además hay receptores D1 estriatales que, al contrario de los D2, aumentan la actividad post sináptica al incrementar la actividad de la enzima adenylciclasa y que contribuirían a la producción de las disquinesias. También sobre el estriato se efectuaban los transplantes de células productoras de dopamina obtenidas de la médula suprarenal, buscando ofrecer un mayor aporte de dopamina a los receptores post sinápticos.
Sin embargo en los últimos 7 a 10 años el centro de la atención está en el globus pallidus interno. Este, uno de los 2 núcleos del pallidus, al estar hiperactivo frena centros motores del tálamo y por consiguiente de la corteza cerebral premotora causando la sintomatología del Parkinson como temblor, hipoquinesia y aumento del tono muscular. Las conexiones entre estriato y globus pallidus interno son a través de una vía directa que inhibe este último núcleo teniendo así un efecto beneficioso en revertir la sintomatología Parkinsoniana. Esta vía cuyo neurotransmisor es GABA es estimulada por receptores D1 que son los que predominan. Hay otra vía estriato - pallidus interno que es estimuladora del globus pallidus interno y por lo tanto su hiperactividad es perjudicial. Esta vía es deprimida por los receptores D2. Esta vía es denominada indirecta pues del estriato pasa al núcleo pallidus externo donde hace sinapsis, posteriormente al núcleo subtalámico y de allí al núcleo pallidus interno. La dos primeras etapas tienen como neurotransmisores a GABA siendo inhibidores. La última del núcleo subtalámico a Pallidus interno es excitatoria siendo neurotransmisor el glutamato. El resultado final es que ejerce una acción activadora del núcleo pallidus interno. Por esto la Levodopa al actuar sobre receptores D1 y D2 ejerce una acción beneficiosa pues estimula la vía directa o inhibitoria y deprime la otra que es excitatoria (Gráfico 2).
Fuente:
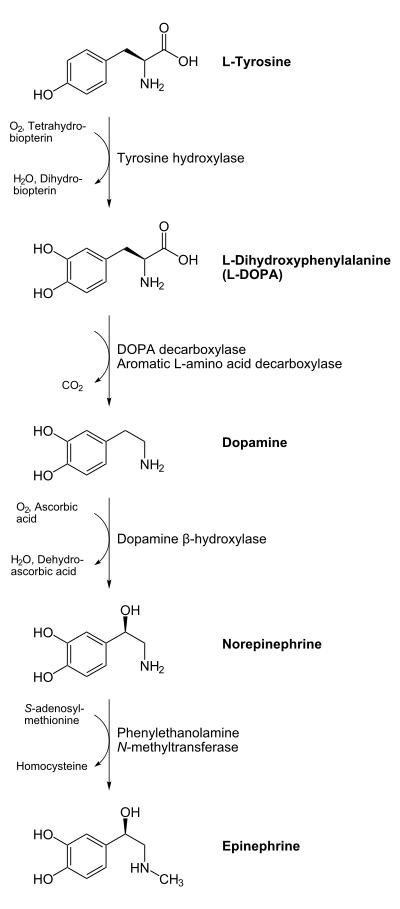
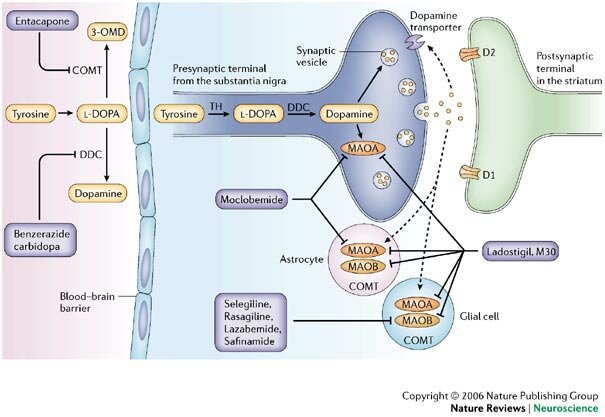
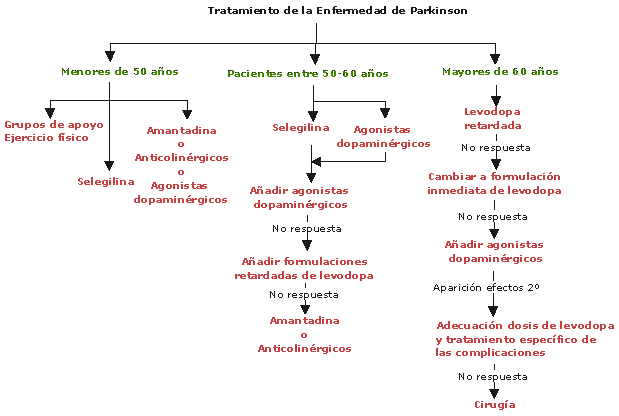
ANTIPARKINSONIANOS Biperideno
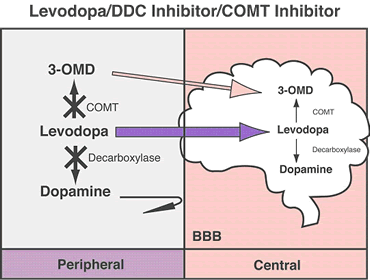
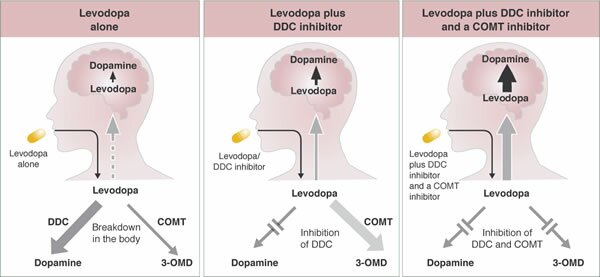
La dopamina no cruza la barrera hematoencefálica. La levodopa, precursor de la dopamina, cruza la barrera hematoencefálica y alivia los síntomas de la enfermedad. Como la levodopa es ampliamente metabolizada en la periferia, sólo una pequeña porción de una dosis administrada alcanza el sistema nervioso central cuando se administra levodopa sin inhibidores de enzimas metabólicas. La carbidopa y la benserazida son inhibidores periféricos del DDC, lo cual reduce el metabolismo periférico de la levodopa a la dopamina y así, se dispone de más levodopa para el cerebro. Cuando se reduce la decarboxilación de la levodopa con la coadministración de un inhibidor del DDC, puede utilizarse una dosis menor de levodopa y se reduce la incidencia de efectos adversos, como la náusea.
Con la inhibición de la decarboxilasa por un inhibidor del DDC, el COMT se vuelve la principal vía metabólica periférica que cataliza la conversión de la levodopa a 3-O-metildopa (3-OMD), un metabolito potencialmente dañino de la levodopa. La entacapona es un inhibidor reversible, específico y que actúa principalmente de manera periférica, del COMT, diseñado para la administración concomitante con la levodopa. La entacapona hace más lenta la depuración de la levodopa de la corriente sanguínea, lo que resulta en un incremento del área bajo la curva (ABC) en el perfil farmacocinético de la levodopa. En consecuencia, la respuesta clínica a cada dosis de levodopa se potencializa y se prolonga.
Clasificación por Farmacodinamia:
AGONISTAS-DOPAMINA:
Favorecen la transmisión de dopamina estimulando los receptores dopaminérgicos. La mayoría de los enfermos necesitan asociar este tratamiento a la levodopa. En estudios de laboratorio se dice que podrían tener un efecto neuroprotector.
Inhibidor-DDC:
Los inhibidores DDC bloquean la enzima dopa-descarboxilasa periférica que causa que la levodopa se descomponga en dopamina. Se asegura que más medicamento llegue a donde se necesita en el cerebro, lo cual también puede reducir algunos efectos secundarios potenciales, tales como náuseas y vómito. Estos efectos secundarios pueden ocurrir cuando la dopamina se encuentra en niveles altos en el torrente sanguíneo.
Inhibidor-COMT:
La COMT (catecol-O-metiltransferasa) es una enzima que interviene en la metabolización de la levodopa antes de su entrada en el cerebro. Los inhibidores de esta enzima se utilizan para aumentar los niveles de levodopa que entran al cerebro y la disponibilidad de dopamina.
ANTICOLINÉRGICOS: Biperideno
Estructura, Aminas Terciarias. Restauran el equilibrio entre la dopamina y acetilcolina en los ganglios basales, bloqueando el exceso de acetilcolina, por la escasez de dopamina por utilización de neurolépticos o enfermedad de parkinson.

Fuente: Farmacología Humana Jesús Flórez.
Estudio comparativo de anticolinérgicos y placebo respecto al tratamiento de la acatisia
Inhibidores de la MAO B(Selegilina): Ver Antidepresivos IMAOS B
Aumentan la disponibilidad de dopamina en el cerebro ya que reducen su degradación. Puede aumentar el tiempo 'on' y disminuir el tiempo 'off' en pacientes fluctuantes y ayuda a reducir las dosis totales de levodopa o el número de tomas.
INMUNOTERAPIA Anti-Alfa-Sinucleína:
Activa (vacuna) o pasiva (anticuerpos). En la inmunoterapia activa es el propio paciente quien genera anticuerpos. La diana es la alfa-sinucleína, de tal forma que el objetivo es evitar la propagación de la alfa-sinucleina que se pliega de forma anómala para formar cuerpos de Lewy, desde la neurona enferma a la sana.
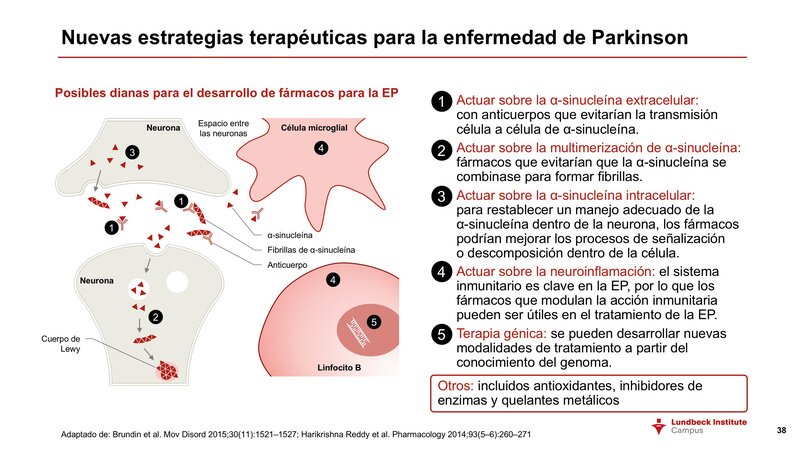
Fuentes:
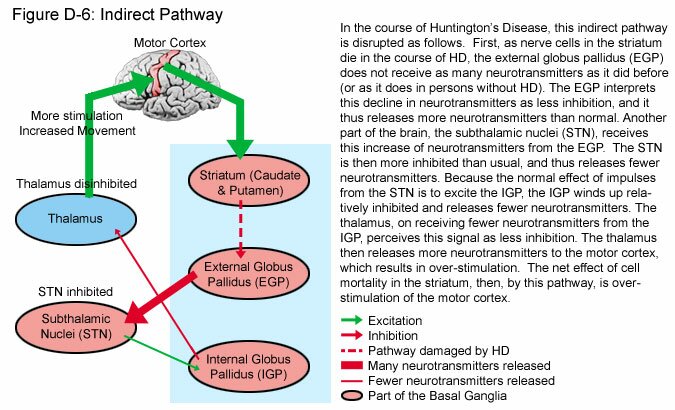
ANTICOREICOS
Utilizados para discinesias tardías, corea de huntington, balismo
Inhibidores del transportador vesicular VAMT:
Depleción de las monoaminas en el citoplasma por inhibición del transportador vesicular que lleva las monoaminas hasta las terminales presinápticas.
Fuentes:
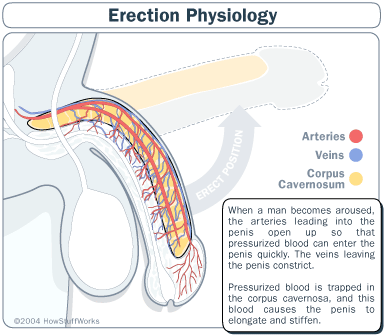
ANTI DISFUNCIÓN ERÉCTIL:
Tabla de comparación de Sildenafilo, Tadalafilo y Vardenafilo En esta tabla podrás apreciar claramente las principales diferencias entre las tres sustancias: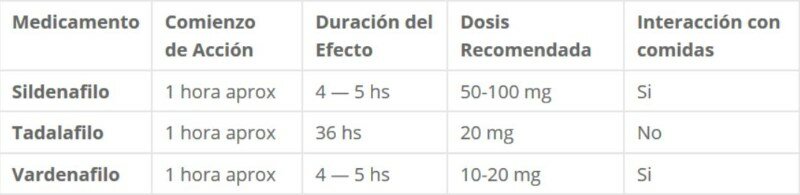
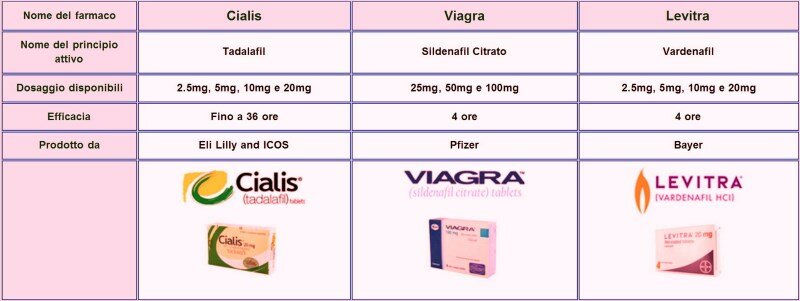
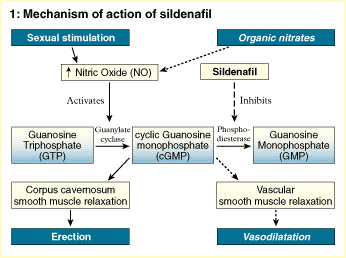
Mecanismo de acción
Tanto el sildenafilo como el tadalafilo y el vardenafilo tienen mecanismos de acción similares. Las tres sustancias inhiben la acción de una enzima llamada fosfodiesterasa tipo 5, que regula la contracción de los músculos lisos en los cuerpos cavernosos del pene.
Cuando la acción de esta enzima está inhibida por alguno de estos medicamentos, los músculos lisos se relajan y permiten el ingreso de sangre al pene, siempre que haya estimulación sexual.
Fuente:
El citrato de sildenafil es una droga que suministrada por vía oral posee un efecto de inhibición marcada de la fosfodiesterasa específica tipo 5 (PDE5) que es una enzima predominante en el cuerpo cavernoso de los humanos. Consecuentemente tiene el potencial de ser efectivo en el tratamiento de la disfunción eréctil ya que el Sildenafil (Viagra) aumenta el efecto de sustancias vasodilatadoras en los cuerpos cavernosos del pene. Una enzima específica es la responsable de la degradación de ese vasodilatador. Por ello un inhibidor selectivo de esa enzima facilita la relajación producida por el óxido nítrico en el músculo liso de los cuerpos cavernosos y aumenta la respuesta erectiva.
Otro mecanismo de amplificación es el implicado en el fenómeno de erección del pene, los científicos determinaron que en este caso el ligando es el NO (oxido nítrico), que es el principal neurotransmisor en el pene. En este caso, a diferencia de los descriptos, el receptor es el hierro del grupo hemo de la enzima guanilato-ciclasa y el segundo mensajero es el GMPc (Guanosin-Monofosfato-ciclico) en vez del AMPc. Una fosfodiesterasa (la isoenzima tipo V es la predominante), está implicada en la inactivación del GMPc y por ende en la finalización de su efecto. La inhibición de esta fosfodiesterasa es la base del efecto del fármaco.
Fuente:
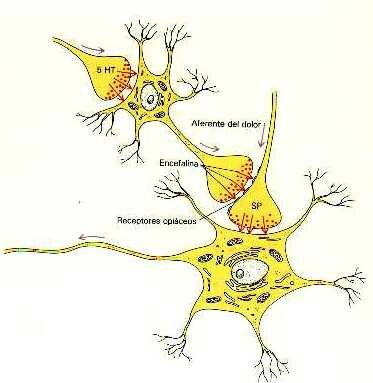
La existencia de estos receptores específicos de opiáceos en el sistema nervioso quiere decir que el organismo debe tener sus propios opiáceos. Efectivamente así es. Estos opiáceos naturales se denominan encefalinas o endorfinas. En esta figura vemos como la una neurona libera al final de su axón encefalina. Esta substancia se une o acopla a los receptores de opiáceos del axón o fibra nerviosa que conduce el dolor para bloquear la transmisión de las sensaciones dolorosas.
Fuente:
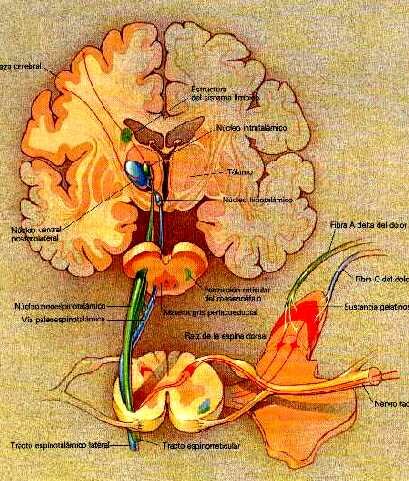
Las substancias derivadas del opio(morfina,heroina) ejercen su acción tanto de alivio del dolor como la euforia que producen al unirse o acoplarse a unos receptores específicos de opiáceos que se hallan ampliamente distribuidos por el cerebro tal como muestra esta figura.El sistema límbico, que como hemos reiteradamente indicado regula y controla nuestras emociones, es rico en estos receptores de opiáceos.

OPIÁCEOS:
Definición y descripción de las propiedades de algunos opiáceos y opioides
El presente resumen, extraído del libro de Seidenberg & Honegger (2000), pretende ser un texto orientativo para comprender mejor los programas de mantenimiento con opiáceos y opioides.
Los opiáceos son conocidos desde hace mucho tiempo como sustancias naturales, que se encuentran en el zumo de las semillas de la adormidera o papaver somniferum. El zumo seco y fermentado se denomina opio y contiene una mezcla de alcaloides opiáceos. En 1806, el químico alemán Fiedrich Serturner consiguió aislar el principal elemento del opio en su forma pura y que llamó morfina. Tras mínimas alteraciones químicas se pudieron obtener opiáceos semi-sintéticos. Desde hace 50 años, es posible obtener substancias completamente sintéticas, casi sin relación química con la morfina, pero con el mismo efecto.
A menudo se utiliza el término opiáceo en vez de opioide. No obstante el término opiáceo se refiere al origen de la sustancia con respecto al opio, es decir, son sustancias que se extraen de la cápsula de la planta del opio. Por extensión, se denominan también así los productos químicos derivados de la morfina. El término opioide se utiliza para designar aquellas sustancias endógenas o exógenas que tiene un efecto análogo al de la morfina y poseen actividad intrínseca. No todos los opioides son opiáceos, ni todos los opiáceos son opioides
Hughes describió en 1975 los péptidos del cuerpo humano que tenían efectos similares a la morfina. Los opioides actúan como éstos péptidos endógenos, denominados también endorfinas. Los péptidos opioides endógenos y las moléculas opioides, ya sean como medicina o como droga, reaccionan en la misma posición receptora específica en la superficie de las células nerviosas y de las células del músculo liso del intestino.
Los ligandos de receptores opioides son sustancias que se unen específicamente a los receptores opioides. Una vez unidos al receptor desarrollan un efecto que se denomina actividad intrínseca, y por esta razón son sustancias denominadas agonistas. Los ligandos de receptores opioides que se unen al receptor, pero no desarrollan efecto alguno, carecen de actividad intrínseca y se denominan antagonistas opioides.
| Opiáceos | Tipo | Características | Actividad Intrínseca | |
| Morfina |
§ Analgésico § Duración del efecto: 4-5 horas § Vida media: 3 horas |
Agonista | ||
| Codeína |
§ Suprime la tos § Duración del efecto: 4-6 horas § Vida media: 3-4 horas |
Agonista | ||
| Tebaína | § Sustancia a partir de la cual se sintetizan la naloxona, naltrexona, y buprenorfina | Agonista parcial | ||
| Papaverina | § Espasmolítico | Antagonista | ||
| Noscapina |
§ Suprime la tos sin adicción potencial
|
Antagonista | ||
| Opioides | Semi-sintéticos |
Heroína, (3, 6 diacetylmorphina, diamorfina DAM) |
§ Analgésico obtenido de la morfina § Duración del efecto: 4-5 horas § Vida media: media hora |
Agonista |
| Buprenorfina |
§ Analgésico § Inhibidor de la abstinencia § Duración del efecto: 6-8 horas § Vida media: 5 horas |
Agonista parcial | ||
| Sintéticos | Metadona |
§ Analgésico § Inhibidor de la abstinencia § Duración del efecto: 8-48 horas § Vida media: 15-22 horas |
Agonista parcial | |
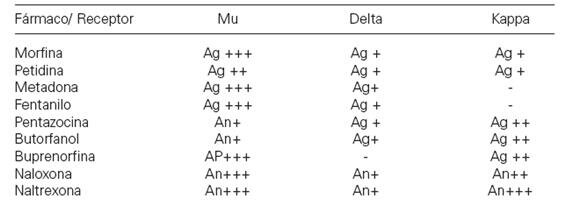
Los opioides naturales y sintéticos, así como los péptidos opioides endógenos, se unen específicamente y con gran afinidad a los receptores opioides, lo que quiere decir que estas sustancias se acoplan perfectamente con los receptores opioides. Los receptores opioides se localizan frecuentemente en la porción final del axón presináptico de la célula nerviosa y modulan la liberación de los neurotransmisores al inhibir la entrada en funcionamiento del potencial de acción, con lo que disminuye la cantidad de sustancia transmisora liberada. El efecto de este receptor opioide es muy marcado en las células nerviosas que transmiten el dolor, donde la liberación de las sustancia transmisora del dolor o sustancia P se inhibe, lo que explica el efecto analgésico sobre los transmisores receptores opioides. Los diferentes opioides se unen con más o menos fuerza a los diferentes tipos de receptores de opioides: mu (m), delta (d) y kappa (k). Los opioides preferidos por los adictos y con un mayor efecto analgésico son los actúan particularmente en los receptoresm
Los opiodes exógenos presentan el llamado dualismo farmacológico. Este fenómeno consiste en que dos fármacos opioides actuando sobre receptores distintos (mu, delta, kappa) ejercen el mismo efecto farmacológico, por ejemplo, analgesia. Pero estos mismos fármacos pueden actuar como agonista en un receptor y agonista parcial o antagonista sobre el otro, siendo el resultado de su interacción distinto, como se muestra en la siguiente tabla: .La actividad intrínseca relativa (AIR) se define como la capacidad de los ligandos para producir un efecto determinado en un receptor. La morfina y la metadona tienen la misma especificidad por el receptor opioide y como agonistas puros tienen el valor máximo de AIR. En principio producen el mismo efecto. Las diferencias subjetivas en lo que se refiere a su eficacia, se explican a través del comportamiento farmacocinético que es distinto para cada sustancia, en la capacidad de atravesar la barrera hemotoencefálica, en la distribución por los diferentes compartimentos (sangre, tejido cerebral, órganos internos) y finalmente en el metabolismo y la excreción.
Cuando hablamos de farmacocinética, nos referimos al transcurso de la concentración, es decir, variaciones de las concentraciones plasmáticas en función del tiempo, en el lugar del efecto. El curso temporal de la concentración depende de la absorción de la sustancia, la distribución en el organismo, el metabolismo y la eliminación. La absorción y la distribución determinan la presencia del fármaco (invasión o flooding) en el lugar del efecto. El abandono del fármaco del lugar de acción (evasión) está prácticamente determinado por el metabolismo y la eliminación.
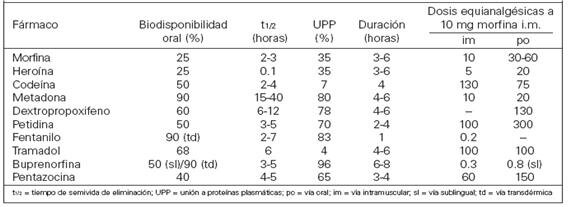
Por vía oral, la mayoría presenta una baja biodisponibilidad (<50%) debido a metabolismo de primer paso hepático. Tras su absorción, se distribuyen rápidamente en el organismo, variando su volumen de distribución entre 1.5 y 4.7 L/kg.
El mecanismo principal de inactivación es el metabolismo hepático que, suele consistir en una oxidación microsomal y la conjugación con ácido glucurónido. La desmetilación mediante el sistema encimático del citocromo P450 2D6, el citocromo (CYP2D6) es relevante en el metabolismo de la codeína, el tramadol y el dextrometorfano. La heroína se desacetilación por esterasa plasmática y la carboxilesterasa hepática en dos pasos, dando en el primero el metabolito 6-Monoacetilmorfina (6-MAM) y en el segundo la molécula de la morfina, parece ser que los efectos de la heroína de deben a la 6-MAM y la heroína que resultan de su metabolismo.Fuentes:
RECEPTORES Y OPIOIDES ENDOGENOS Y EXÓGENOS
INTRODUCCION :Hasta ayer se llamaba OPIOIDES a los agonistas endógenos de los receptores opiáceos y OPIACEOS a los agonistas exógenos.
Hoy se los denomina opioides endógenos y opioides exógenos respectivamente.
RECEPTORES- HISTORIA
Existen una serie de evidencias que avalan el concepto de Receptor: (ver diapo 1)1: La morfina es un alcaloide proveniente de una planta el papaver somniferum
2: Existe una similitud de fórmula química entre los distintos opioides como por ej. existen - amplias superficies lipofílicas en ángulo recto una respecto a la otra
un OH que se une por su H.
un N + que forma un puente iónico.
3. : Existe estereoisomería: el isómero levógiro es el farmacológicamente activo
mientras que el isómero dextrógiro no es activo salvo el dextrometorfan que es
antitusígeno y hoy se sabe que es un antagonista no competitivo del receptor NMDA.
4: Existe un antagonista para los opiodes que es la NALOXONA que revierte rápidamente la acción farmacología de los opioides
En 1967 Martín y colab. postularon la existencia de más de un tipo de receptor para los opioides y drogas afines, por las complejas interacciones de drogas del tipo de la Morfina, los antagonistas y lo agonistas - antagonistas.
En 1973 Snyder y Pert, Simon y Edelman, y Terenius, describieron separadamente sitios de unión estereoespecíficos saturables para los opioides y drogas afines.
En 1976 Martin y colab. descubrieron muchas categorías de receptores y los clasifica .
DESARROLLO DEL TEMA
CLASIFICACIÓN DE LOS RECEPTORES
(Ver diapo 2)Existen tres tipos de receptores: Mu, delta y kapa.
Hoy se sabe que hay 3 categorías de receptores opioides:
Mu1 y Mu2
K1a, 1b,2ª,2b
Delta 1 y delta 2
Epsilon, para el sistema inmunitario
. El receptor epsilon no se considera receptor opioide sino que está involucrado al sistema inmunitario.El receptor mu y el delta poseen un peso molecular entre 150 .000 y 750-875.000.
El receptor kappa, posee una estabilidad única, es resistente al calor y posee un peso molecular entre 30.000 - 400.000 p.m.
Los receptores mu representan el 22% de los R. opioides
Los receptores delta el 35%
Los receptores kappa el 42%
entre los tres reúnen el 99% de los receptores
Hoy se sabe que existen receptores diferentes, presentes en una misma célula, lo que se llama CONEUROTRANSMISIÓN.
Fuente:
RECEPTORES OPIOIDES MULTIPLES
Ya conocemos los 3 básicos, pero existe uno experimental pero tiene indicios de ser un receptor importante, dentro del receptor Mú hay subtipos (Mú1, Mú2), Kappa (k1, k2, k3), y Delta (Delta1y Delta2), el receptor en fase experimental se denomina receptor epsilon (E).
La analgesia está relacionada con receptores Mú básicamente de localización supraespinal, y Kappa en médula espinal, en otras palabrasa nivel supratentorio tenemos Receptores Mú y en espinal tenemos Kappa ambos modulan dolor, pero existen los haces espinotalámicos laterales por donde corre la vía del dolor y estos pasan obligatoriamente por médula para integrarse en los núcleos centrales tálamo y corteza por que si no el dolor se está presentando pero no integrándose por lo tanto no lo sentimos como tal, por que es una percepción subjetiva, no lo pueden medir para ser subjetivo tiene que integrarse en el cerebro.
Un compuesto opioide puede actuar en los receptores como agonista o antagonista dependiendo de donde esté y dependiendo del receptor que sea, ese opioide puede ser agonista aliviando el dolor, o como antagonista potenciándolo, los agonistas opioides tienen predilección por receptores Mú, los antogonistas como naloxona, otros que actúan como agonistas y antagonistas (nalofina, pentasufina), y aquellos que tienen efecto eufarizante o disforía (alteración del estado de ánimo), son poco antagonizado por naloxona, los fármacos de acción mixta (agonista y antagonista) pueden potenciar la acción de la naloxona y no eliminarla, los agonistas parciales como la Butrenolfina que tiene un efecto total sobre los receptores. Recordando lo que es la vía del dolor actúa sobre receptores que están a nivel de piel, estos a su vez transmiten por vías aferente por las fibras mielinizadas “A” o fibras desmielinizadas “C” entran por las raices dorsales y llegan al haz espinotalámicos laterales (dolor y temperatura), y también entramos al espinoreticular (dolor y tacto), que llega a formación reticular en médula y en meséncéfalo, tálamo y corteza sensorial, luego nos devolvemos por mesencéfalo, astas dorsales y llegamos a la sustancia gelatinosa de Rolando que es quién emite la respuesta motora, los neurotransmisores involucrados Glutamato y Aspartato (Aminoácidos excitatorios), Neuropeptidos (Sustancia P, Somatostatina, VIP, Colecistoquinina) y los Neuromoduladores (GABA, Glicina, 5-HT).
Fuente:
Conocidos como "Narcóticos" (que significa adormecimiento), se utilizan principalmente para combatir el dolor. Son legales para uso médico, por sus propiedades analgésicas.
Son derivados preparados a partir de la Goma de Opio (Papaver Somniferum), misma que se obtiene a partir del jugo extraído de los bulbos de la amapola.
En 1803 se aísla un alcaloide del opio al que se le llamó Morfina por el Dios griego del sueño "Morfeo", que es diez veces más potente que el opio y posteriormente se desarrollaron otros derivados como la Codeína que deprime la tos y la Heroína (1874), que es diez veces más potente que la morfina. Su nombre viene por ser la droga "heroica" en las guerras.
Los opiáceos son las drogas con mayor poder adictivo, debido a entran en el cerebro rápidamente. Entre los efectos que producen estas drogas están el de analgesia, somnolencia, cambios del estado de ánimo, depresión respiratoria, nausea, vómito, "miosis" (constricción pupilar) y disminución de la motilidad del tubo digestivo.
El efecto analgésico que produce la morfina tiene la particularidad de que ocurre sin pérdida de la conciencia y no afecta otras modalidades sensoriales, sin embargo es muy importante en caso de intoxicación, no permitir que el sujeto duerma ya que el efecto como depresor en la respiración, se suma al mismo efecto causado por el sueño y esto aumenta el riesgo de muerte por asfixia.
Los cambios conductuales se identifican con la euforia inicial, la apatía, lentitud psicomotora, el deterioro en el proceso del pensamiento y en la capacidad de atención y memoria, así como con cambios drásticos en actitudes escolares y sociales.
Fuente:
Opioides endógenos
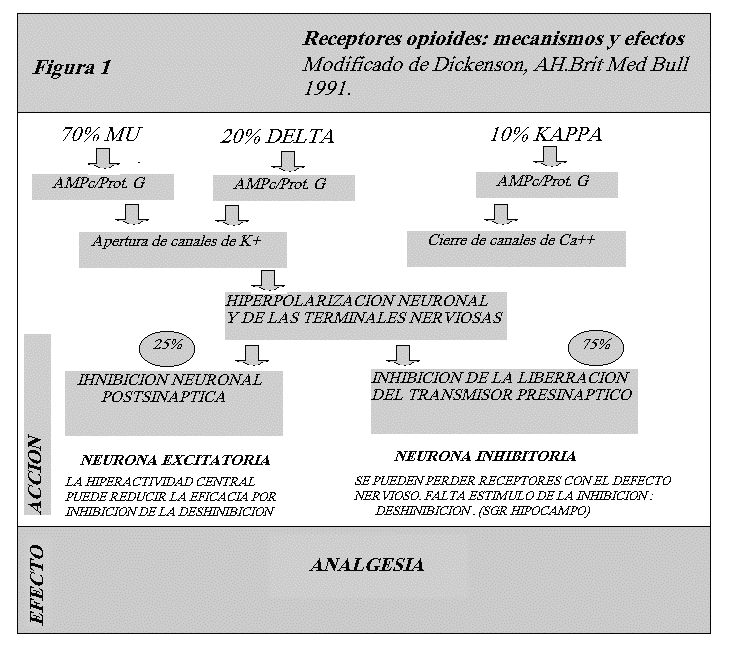
Existen tres grupos diferentes de opioides endógenos: encefalinas, endorfinas y dinorfinas. Los tres derivan de moléculas polipeptídeas precursoras: proencefalina, pro-opiomelanocortina y prodinorfina. En el SNC existen tres receptores opioides: mu, kapa y delta. La mayor concentración de receptores opioides se encuentra en las regiones sensoriales, hipotálamo, y sistema límbico del cerebro, en especial en la substancia gris periacueductal, y la amígdala. Los receptores opioides facilitan la neurotransmisión inhibitoria en el cerebro y en el sistema gastrointestinal. Inhiben la liberación de otros neurotransmisores y neuropéptidos como son dopamina, acetilcolina, 5HT y CRH. Estos receptores actúan todos uniéndose a la proteína G, y además el mu y delta actúan a través de los canales de potasio y la adenilciclasa, mientras que los kapa lo hacen inhibiendo los canales de calcio.
Fuentes:
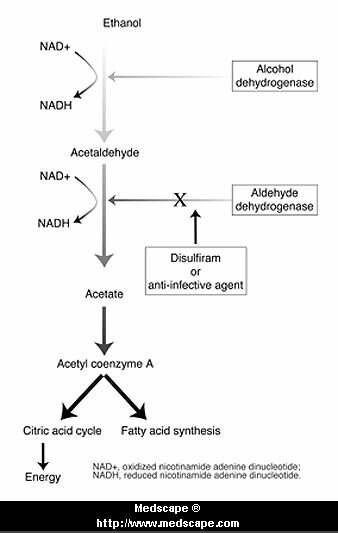
ANTIVICIO:
ANTIALCOHÓLICOS:
Incluye tanto antiopiáceos como aversivos (bloqueo de la enzima acetaldehído deshidrogenasa)
ANTITABÁQUICOS:
Grupo que incluye:
Antagonistas opiáceos que actúan por competición específica con los receptores localizados principalmente en el sistema nervioso central, periférico , como la Naltrexona (antimu).
Sistema Opioide Endógeno y otras Drogas
En relación con este último punto se han obtenido en los últimos años evidencias claras de que el funcionalismo del sistema opioide endógeno no solamente está implicado en el abuso de sustancias como la heroína, sino que también juega un papel importante en las propiedades reforzadoras de otras drogas. De forma resumida podríamos decir que se ha propuesto la existencia de un sistema opioide endógeno de recompensa que sería activado por las drogas de abuso, de forma que al menos parte del potencial adictivo de las mismas podría modularse farmacológicamente mediante la utilización de fármacos activos sobre receptores opioides. Existen evidencias preclínicas de que ésto podría ser así en el caso de los psicoestimulantes, cannabinoides, nicotina y alcohol; con esta última droga de abuso se ha podido demostrar la utilidad clínica de esta estrategia terapéutica, ya que es bien conocida la disminución del consumo de alcohol que puede obtenerse en pacientes tratados con el antagonista opioide naltrexona. No sería extraño por tanto que en un futuro nos encontremos con una utilización más extendida de ligandos opioides (posiblemente agonistas parciales o antagonistas) en tratamientos de deshabituación a diversas drogas de abuso, o bien con sustancias activas sobre el sistema opioide endógeno en virtud de otros mecanismos de actuación. La vulnerabilidad individual al consumo de drogas es otro de los fenómenos en los que el sistema opioide endógeno parece estar significativamente implicado. Trabajos realizados con cepas de ratas especialmente susceptibles al efecto reforzador de distintas drogas muestran que estos animales exhiben diferencias en cuanto a su tono opioide basal o a la respuesta del sistema opioide tras la exposición a una droga. También en el caso del alcohol nos encontramos con datos clínicos concordantes, ya que se ha demostrado que la predisposición genética al consumo de dicha sustancia se correlaciona positivamente con el incremento que produce sobre la liberación de b-endorfina y encefalinas. Conclusión Se puede concluir por tanto que el estado actual de la investigaciones sobre el papel del sistema opioide endógeno en las drogodependencias abre nuevas expectativas farmacológicas para ayudar a limitar el consumo de distintas drogas de abuso, de forma semejante a lo ya descrito en el caso de la naltrexona y el alcohol.
Fuente:
En el caso de los antitabáquicos ver antidepresivos inhibidores de la recaptación neuronal de noradrenalina y dopamina como el Bupropion en los antitabáquicos.
En el caso del Disulfiram:
Inhibe la oxidación del acetaldehído (producto del metabolismo del alcohol) y es por ello que la ingestión de alcohol durante el tratamiento con disulfiram provoca una molesta y desagradable respuesta (vómitos, cefaleas, disnea, sudoración, precordialgias).
Su mecanismo de acción se debe a la inhibición de la aldehído deshidrogenasa hepática. El acetaldehído es responsable de los efectos desagradables que persisten hasta tanto se metabolice el alcohol ingerido sin interferir su eliminación. El disulfiram se absorbe y elimina lentamente; los efectos se conservan hasta una o dos semanas después de ingerida la última dosis; no produce tolerancia.
COMENTARIOS DE: Biperideno
buenos dias esta agotado este medicamento en venezuela y nos urge la administracion en pacientes con parkinson
Comentarios 1 a 3 de 3
6 meses para responder posts antiguos
¡Queremos tu opinión!
Si pregunta sobre este fármaco revise antes estos dos enlaces en particular
Ahora ya puede entender el prospecto y la ficha técnica